Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Изображение комплексных чисел радиус-векторами координатной плоскости
Рассмотрим плоскость с заданной на ней Oxy и напомним, что радиус-вектором на плоскости называют вектор, начало которого совпадает с началом системы координат.
Назовем рассматриваемую плоскость комплексной плоскостью, и будем представлять комплексное число z = x + i y радиус–вектором с координатами (x , y).
Назовем ось абсцисс Ox вещественной осью, а ось ординат Oy – мнимой осью.
При таком представлении комплексных чисел сумме комплексных чисел соответствует сумма радиус-векторов, а произведению комплексного числа на вещественное число соответствует произведение радиус–вектора на это число.
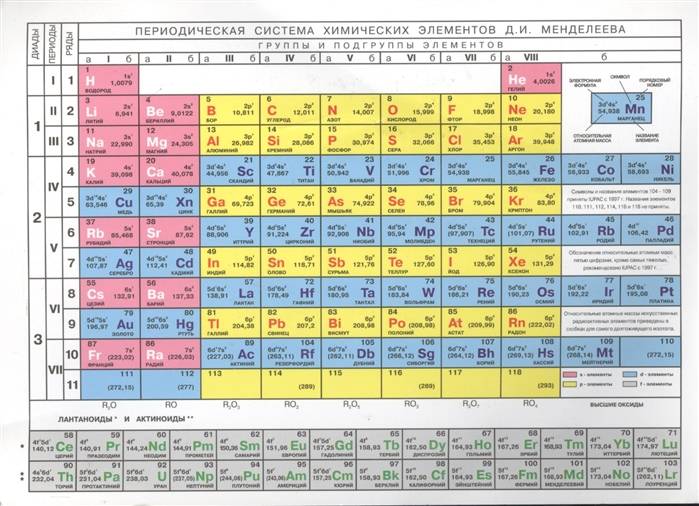
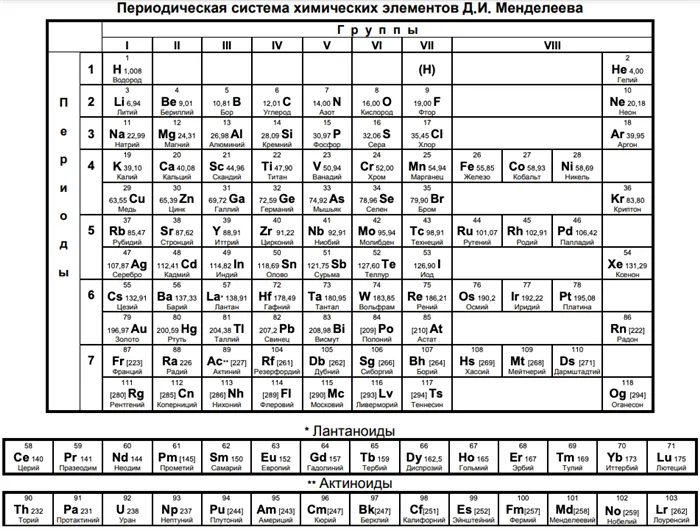
Таблица Менделеева с выделением главных и побочных подгрупп
Элементы главных подгрупп обозначены фиолетовым цветом, побочных – серым. Я напоминаю, что свойства элементов, находящихся в одной группе, но в разных подгруппах, отличаются достаточно сильно.
Например, натрий, калий, медь и серебро находятся в I группе: Na и K – в главной подгруппе, Cu и Ag – в побочной. Свойства натрия и калия весьма похожи – активные металлы, бурно реагирующие с водой, легко окисляющиеся на воздухе, имеют низкие температуры плавления и кипения. Все это сильно отличается от свойств меди и серебра: инертные металлы, которые не реагируют не только с водой, но и с большинством кислот, на воздухе устойчивы, температуры плавления и кипения достаточно высоки.
Еще ярче отличия заметны, например, в VI группе. Кислород, сера, селен (главная подгруппа) – типичные неметаллы, а хром, молибден и вольфрам, находящиеся в побочной подгруппе, относятся к металлам.
Все проблемы исчезают, если вы используете таблицы Менделеева: “мешанина” из элементов главных и побочных подгрупп исчезает, и мы начинаем отчетливо видеть логику периодического закона.
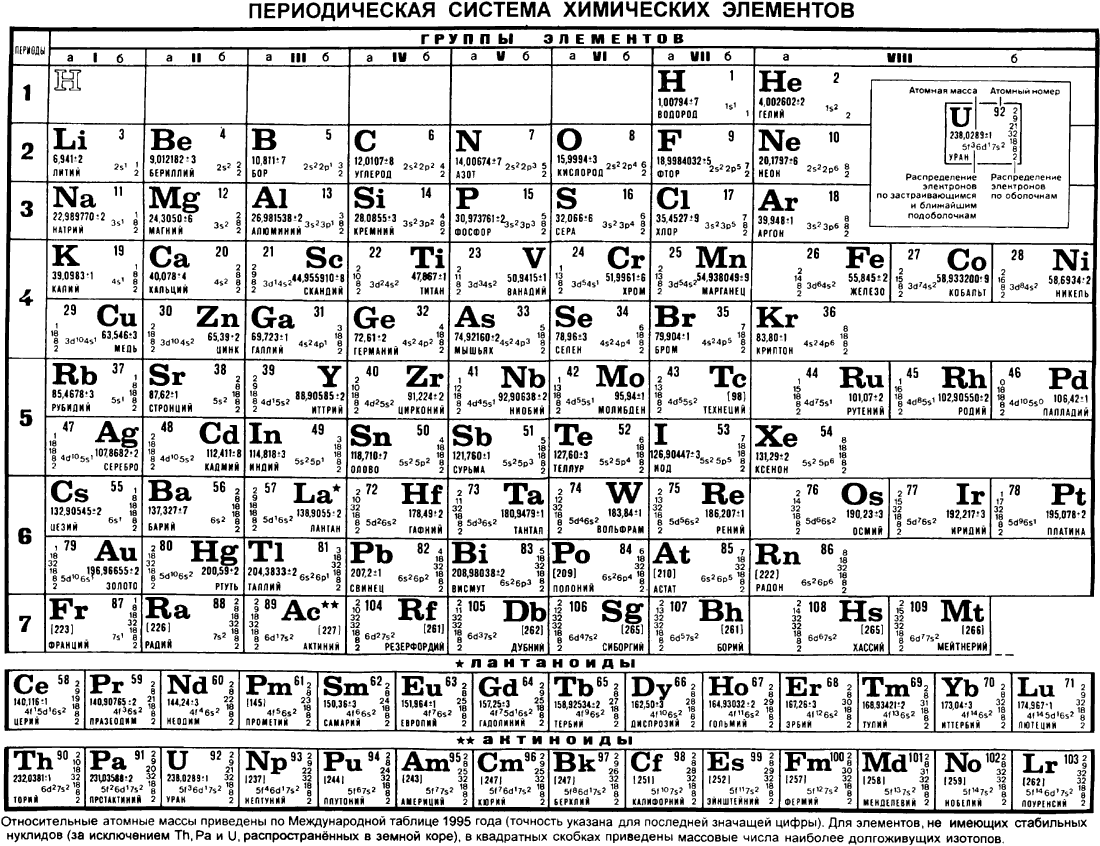
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 | 1 | 1 | 2 | |||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | |||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 |
47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | |||
| 6 | 55 | 56 | 57 | 72 | 73 | 74 | 75 | 76 | 77 | 78 |
79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | |||
| 7 | 87 | 88 | 89 | 104 | 105 | 106 | 107 | 108 | 109 | 110 |
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||
| Водородные соед. | RH4 | RH3 | H2R | HR |
| *Лантаноиды | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
| ^Актиноиды | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
Заключения
Теория строения атомов объясняет периодическое изменение свойств элементов. Увеличение положительных зарядов атомных ядер от 1 до 109 обусловливает периодическое повторение структуры внешнего энергетического уровня. А так как свойства элементов в основном зависят от количества электронов на внешнем уровне, то они периодически повторяются. Таков физический смысл периодического закона.
В небольшие периоды с ростом положительного заряда ядер атомов количество электронов на внешнем уровне увеличивается (от 1 до 2-в первом периоде, и от 1 до 8-во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) является щелочным металлом, затем металлические свойства постепенно ослабевают и свойства неметаллических
В большие периоды с увеличением заряда ядер заполнение электронов сложнее, что объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов. Таким образом, число электронов на внешнем уровне остается в четных рядах больших периодов с ростом заряда постоянным и равно 2 или 1. Поэтому, пока электроны заполняются по внешней (второй внешнем) уровне, меняются свойства элементов в этих рядах очень медленно. Только в нечетных рядах, когда количество электронов на внешней плоскости увеличивается (от 1 до 8), свойства элементов начинают меняться так же, как и типичные.
В свете учения о строении атомов разделение д. и. Менделеева обосновывается всех элементов на семь периодов. Число периода равно количеству энергетических уровней атомов, заполненных электронами. Поэтому s-элементы присутствуют во всех периодах, P-элементы – во втором и последующем, d-элементы-в четвертом и последующих, а f-элементы-в шестом и седьмом периодах.
Легко объяснить и деление групп на подгруппы, исходя из разницы в электронном наполнении энергетических уровней. Для элементов основных подгрупп заполняются либо s-подуровни (это s-элементы) , либо P-подуровни (это P-элементы) внешних плоскостей. Заполнены элементы вспомогательных групп (d-подуровень второй внешней плоскости (это d-элементы). У лантаноидов и актиноидов соответственно заполняются подуровни 4f и 5f (это элементы f). Таким образом, в каждой подгруппе объединяются элементы, атомы которых имеют сходную структуру внешнего электронного уровня. При этом атомы элементов основных подгрупп на внешних уровнях содержат количество электронов, равное номеру группы. Второстепенные подгруппы включают элементы, атомы которых на внешнем уровне имеют два или один электрон.
Так, строение атомов вызывает две закономерности: 1) изменение свойств элементов по горизонтали-в период слева направо ослабляется металл и усиливаются неметаллические свойства; 2) изменение свойств элементов по вертикали-в подгруппе с ростом серийного номера усиливаются свойства металла и слабеют неметаллические. В этом случае элемент (и ячейка системы) находится на пересечении горизонтального и вертикального, что определяет его свойства. Это помогает найти и записать свойства элементов, изотопы которых получены искусственно.
Структура таблицы
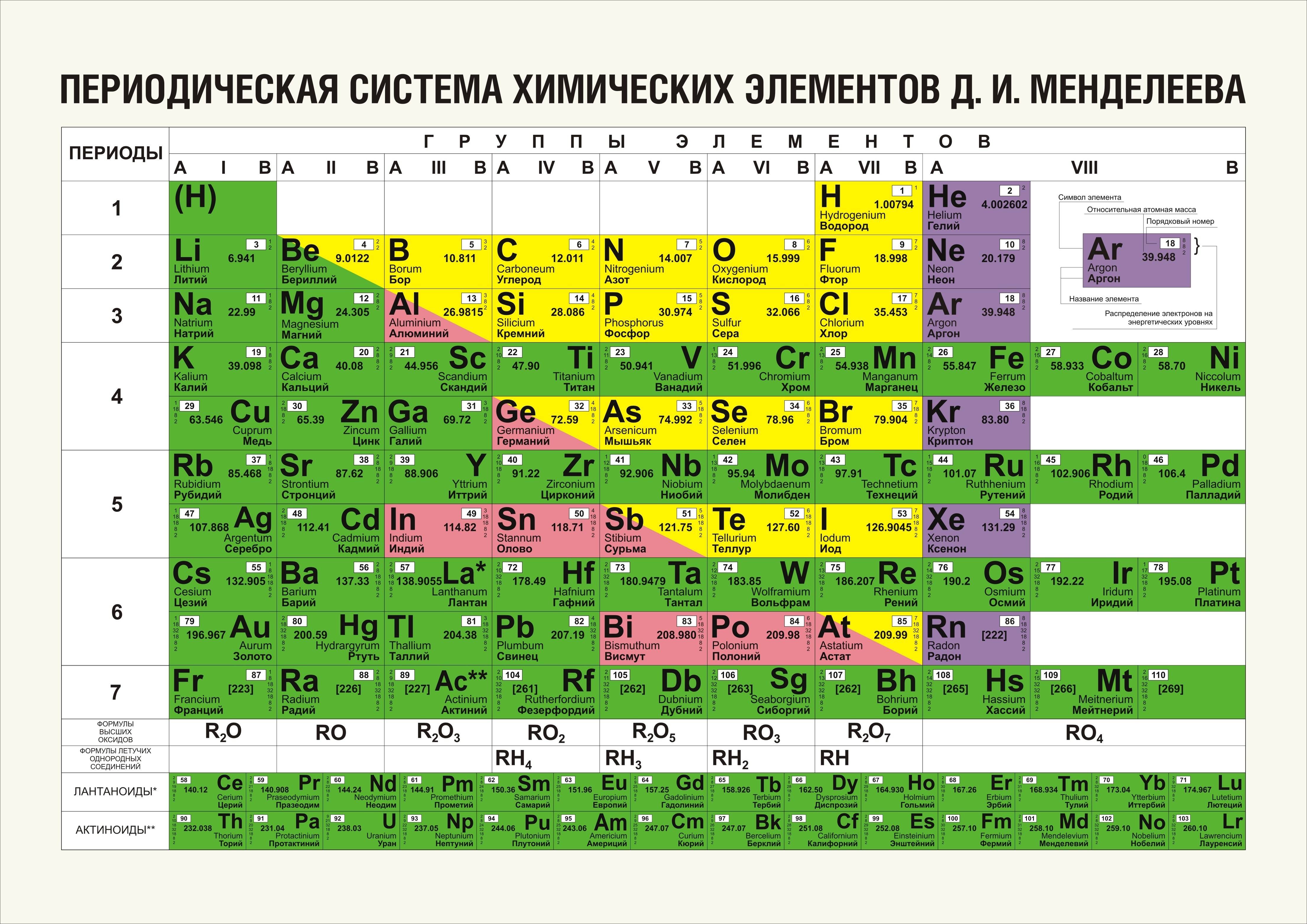
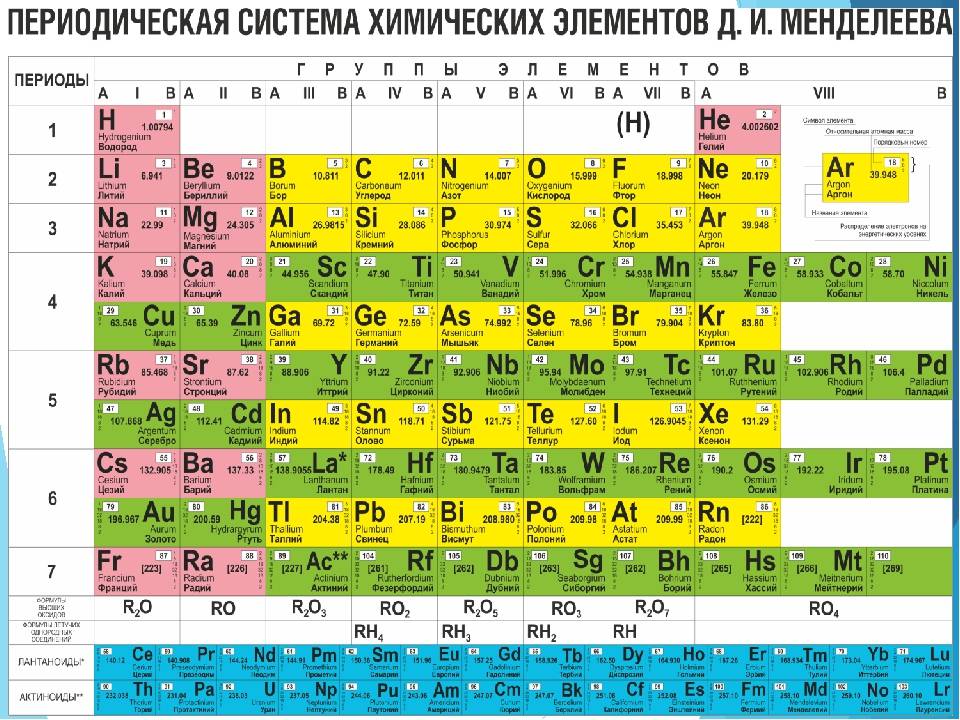
В таблице Менделеева химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы. Таблица состоит из семи периодов и восьми групп.
Периоды — это горизонтальные ряды в таблице.
Элементы, которые относятся к одному периоду, показывают следующие закономерности с увеличением их порядкового номера:
- Возрастает электроотрицательность.
- Металлические свойства убывают, неметаллические возрастают.
- Атомный радиус падает.
Периоды в таблице делятся на:
- малые;
- большие.
Малыми называются периоды, которые содержат небольшое количество элементов. Это первый, второй и третий периоды, первый состоит из 2-х, второй и третий из 8 элементов.
Все остальные периоды — это большие периоды. Четвертый и пятый состоят из 18 элементов, шестой — из 32-х, седьмой — из 24-х.
В нижней части таблицы Менделеева расположены химические вещества, которые называются лантаноидами и актиноидами.
Таблица периодической системы содержит десять рядов. Малые периоды состоят из одного ряда, большие периоды содержат по два ряда. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В четных рядах содержатся металлы, в нечетных рядах — неметаллы.
Периодическая система начинается водородом — первым химическим элементом, а заканчивается на сегодняшний день 118-м — оганесоном. Ученые утверждают, что таблица не закончена, идет активный поиск 119-го элемента.
Как таблицу Менделеева пополнили ядерные элементы
 Здесь создают новые химические элементы
Здесь создают новые химические элементы
Вряд ли Менделеев предполагал, как далеко зайдут его последователи в поиске продолжения таблицы: в его время элементы получали только из природных материалов — минералов, руд.
Открытие ядерной реакции позволило создать новый способ «пополнения» таблицы: расщепление урана (элемент 92) позволило создать трансурановые элементы, вместе с которыми известно 118 элементов.
Все они не существуют в природе в достаточном для поиска количестве, либо имеют слишком короткий срок жизни. Для их получения ученые сталкивают атомы разных элементов (сегодня используют комбинацию «пучок атомов»->«мишень») , что приводит к их слиянию.
 Юрий Оганесян из НИЯУ МИФИ, соавтор открытия 5 трансурановых элементов
Юрий Оганесян из НИЯУ МИФИ, соавтор открытия 5 трансурановых элементов
Например, для создания теннесина (номер 117 соответствует числу протонов в ядре) ученые объединили пучки кальция (20 протонов) с мишенью из беркелия (97 протонов).
Синтез кальция с калифорнием (98) позволил появиться на свет долгоживущему изотопу оганесона (118).
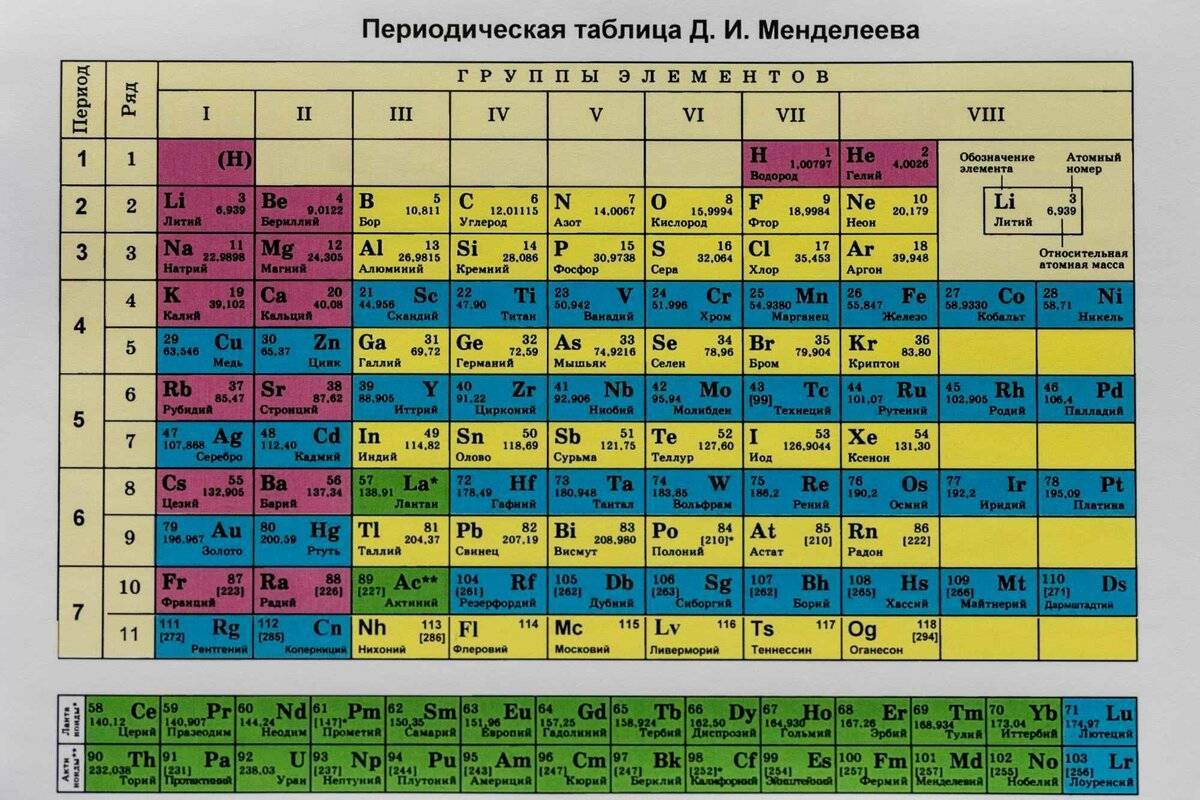
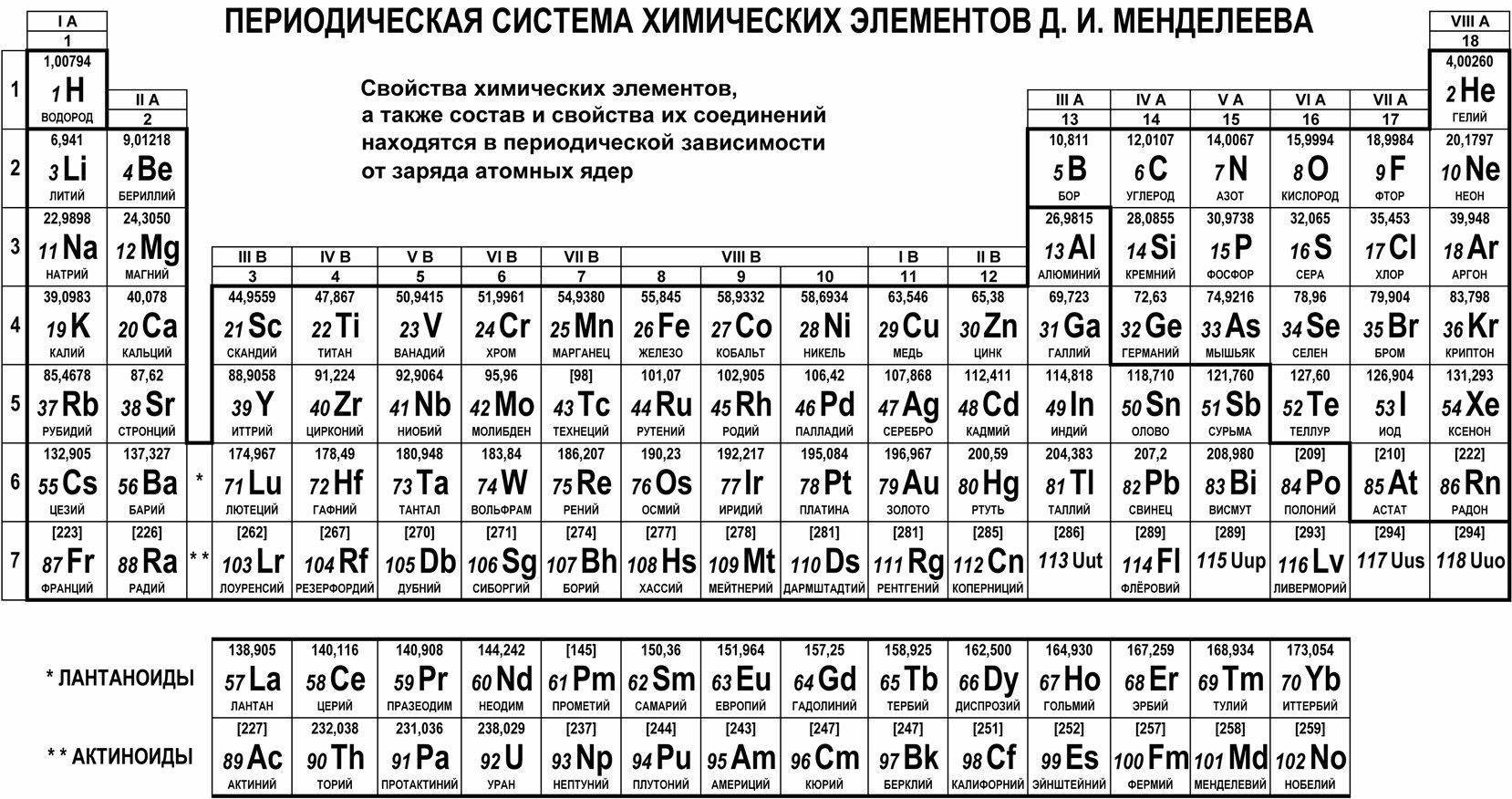
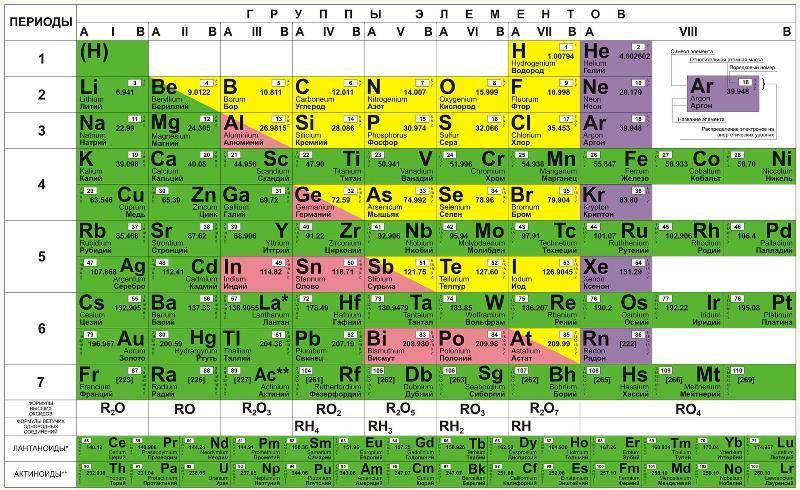
Современный вид таблицы Менделеева
Ниже приведем саму таблицу

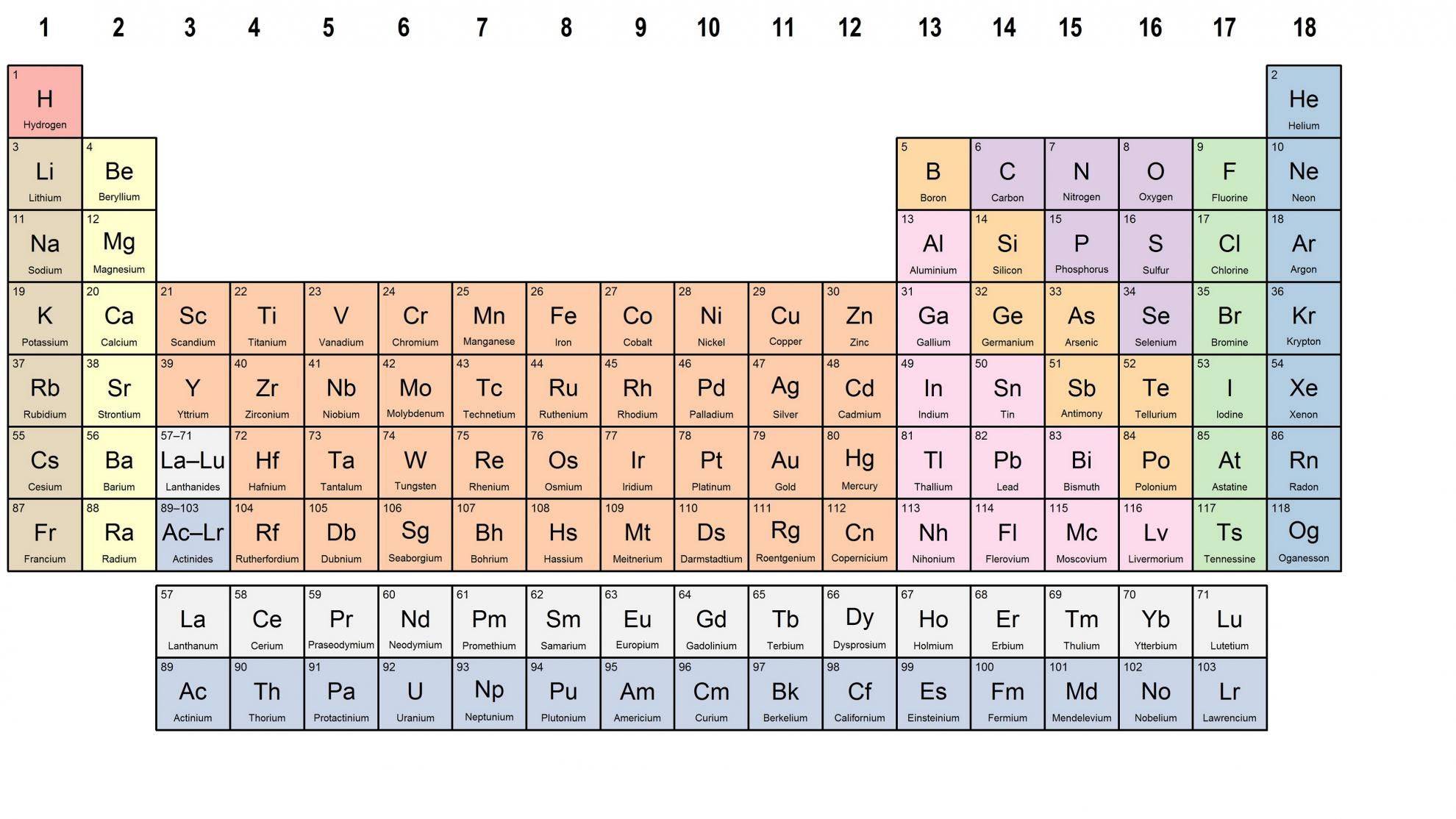
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе, который с радостью поделится с вами своими знаниями и опытом.
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны
Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу
Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
 Д. И. Менделеев (1834-1907)
Д. И. Менделеев (1834-1907)
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
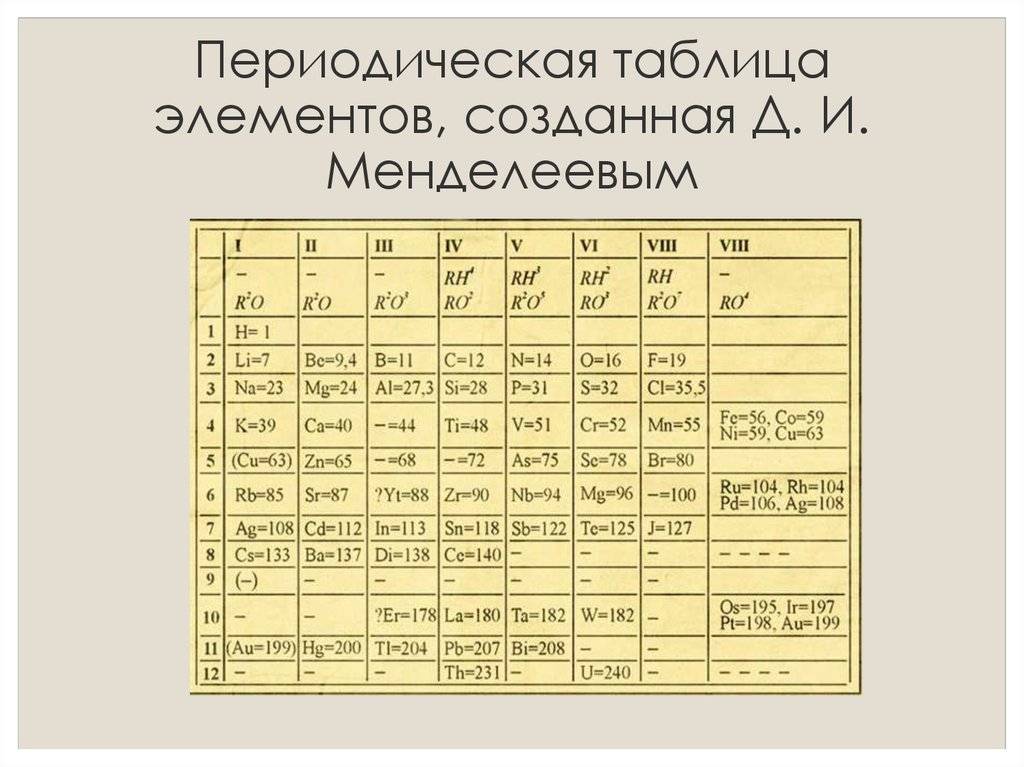
 Первоначальный вариант таблицы Менделеева
Первоначальный вариант таблицы Менделеева
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
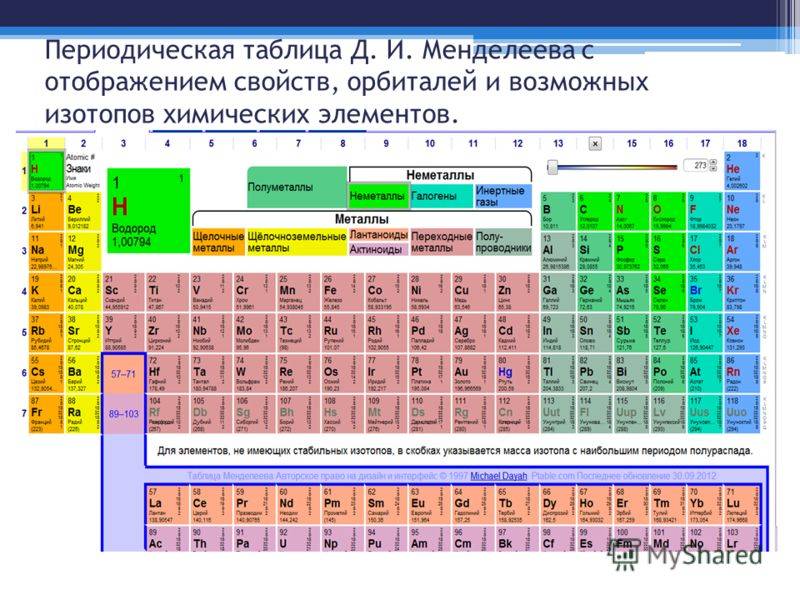
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Это основа неорганической химии.

Неорганическая химия – это практически изучение таблицы Менделеева. Без этого все знания, полученные в отношении этого типа материи, рухнули бы
Тем, кто занимается этой областью химии, важно, чтобы они могли прочитать и извлечь всю информацию, которую предлагает эта таблица о химических элементах, помимо углерода и его изотопов
Для химиков-органиков часто достаточно взглянуть на правую часть таблицы Менделеева: точнее на верхнюю часть блока. п, где находятся углерод и различные неметаллы.
Вместо этого химики-неорганики должны изучить все металлы, из которых состоят блоки. d Y F, а также группа благородных газов 18, поэтому они в конечном итоге знакомятся со всеми химическими элементами; кроме, пожалуй, синтетических и высокорадиоактивных.
Прогнозировать свойства новых элементов
Вначале периодическая таблица содержала пустые места, поскольку к тому времени некоторые химические элементы не были обнаружены.
Расположение этих пространств указывало на то, что новый элемент в соответствии со своими сородичами должен реагировать аналогичным образом; и даже более того, его даже можно было найти в тех же минеральных источниках.
И именно при химической обработке бесконечных минералов медленно обнаруживались недостающие химические элементы; например, галлий, германий и скандий. Галлий, находясь ниже алюминия, должен был разделять с ним свойства и образовывать однотипные минералы (оксиды, сульфиды, хлориды и др.).
Если бы элемент 119 был создан, он обязательно должен был бы располагаться ниже франция, в группе 1; и, следовательно, реагируют или обладают химическими свойствами, аналогичными свойствам других щелочных металлов (лития, натрия, калия и т. д.).
Алгебраическая форма записи комплексных чисел
Пусть x и y – произвольные вещественные числа.
Множеством комплексных чисел называют множество всевозможных пар (x, y) вещественных чисел, на котором определены операции сложения, вычитания и умножения по правилам, описанным чуть ниже.
Множество комплексных чисел является расширением множества вещественных чисел, поскольку множество вещественных чисел содержится в нём в виде пар (x, 0).
Комплексные числа, заданные парами (0, y), называют чисто мнимыми числами.
Для комплексных чисел существует несколько форм записи: алгебраическая форма записи, тригонометрическая форма записи и экспоненциальная (показательная) форма записи.
Алгебраическая форма – это такая форма записи комплексных чисел, при которой комплексное число z, заданное парой вещественных чисел (x, y), записывается в виде
| z = x + i y . | (1) |
где использован символ i , называемый мнимой единицей.
Число x называют вещественной (реальной) частью комплексного числа z = x + i y и обозначают Re z.
Число y называют мнимой частью комплексного числа z = x + i y и обозначают Im z.
Комплексные числа, у которых Im z = 0 , являются вещественными числами.
Комплексные числа, у которых Re z = 0 , являются чисто мнимыми числами.
Тригонометрическая и экспоненциальная формы записи комплексных чисел будут изложены чуть позже.
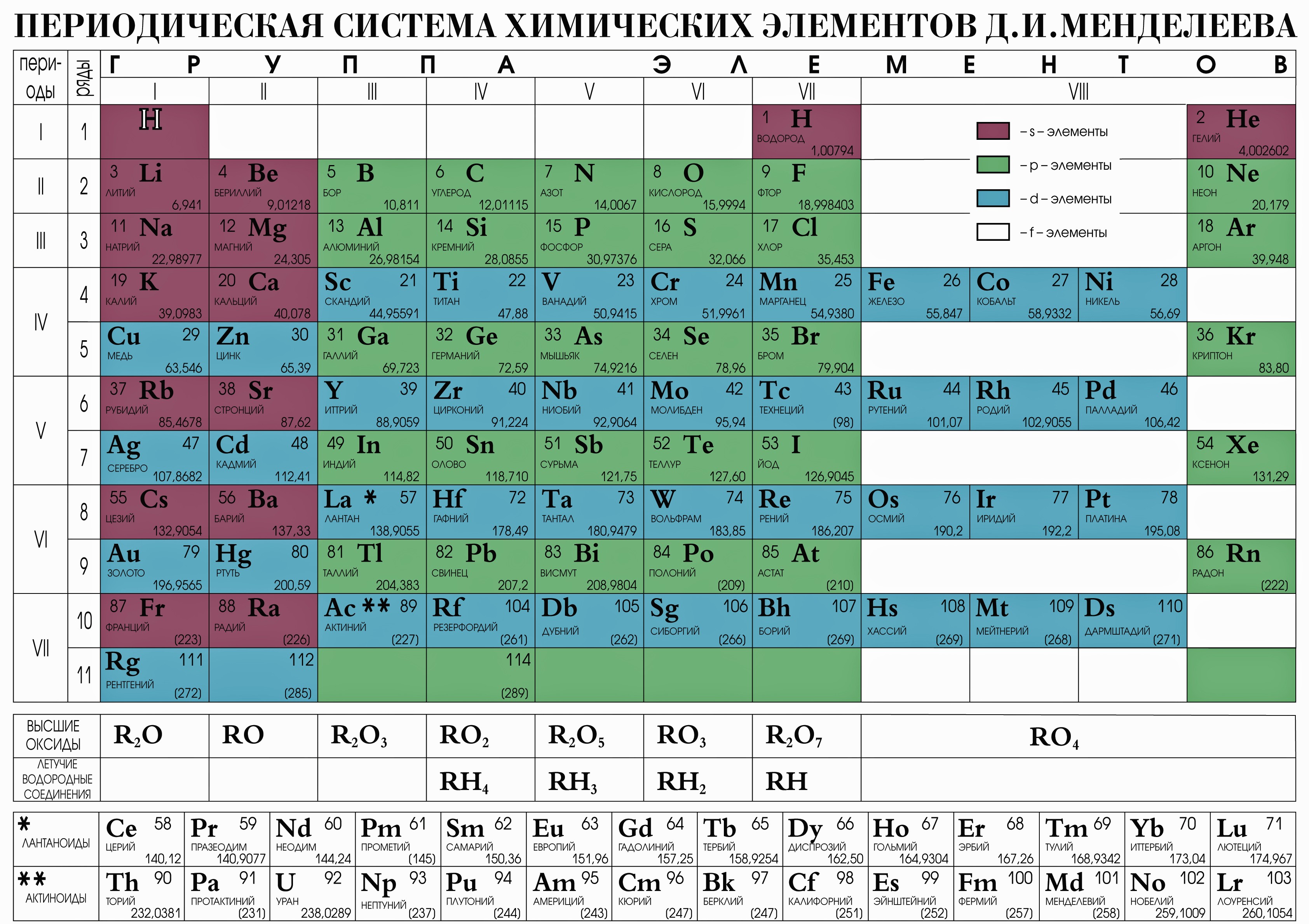
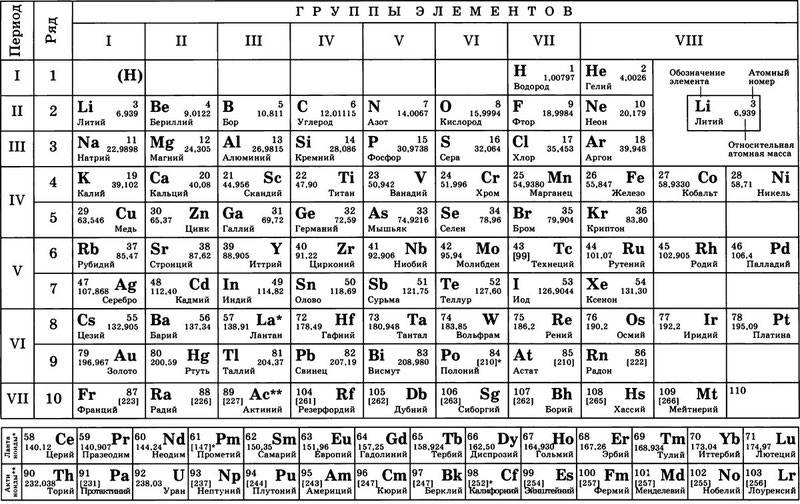
Классический вариант таблицы Менделеева
Вероятно, именно такой вариант периодической таблицы является для вас наиболее привычным. Нечто подобное мы видим в любом школьном учебнике химии. К сожалению, данный вариант (т. н. короткопериодный) не очень наглядно отражает периодический закон. Возьмите, например, элементы седьмой группы: ярко выраженные неметаллы (F, Cl, Br, I) соседствуют здесь с типичными металлами (Mn, Tc, Re).
А ведь мы ожидаем видеть в одной группе элементы с похожими свойствами.
Приходится выделять т. н. главные и побочные подгруппы, прибегать к другим ухищрениям (например, “вырезать” из таблицы лантаноиды и актиноиды). В действительности, правильный вариант таблицы Менделеева , а короткопериодная форма – это некоторый компромиссный вариант, который используется в целях экономии места.
| Периоды | Группы элементов | |||||||||
| I | II | III | IV | V | VI | VII | VIII | |||
| 1 | 1 | 1 | 2 | |||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | |||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 |
47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | |||
| 6 | 55 | 56 | 57 | 72 | 73 | 74 | 75 | 76 | 77 | 78 |
79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | |||
| 7 | 87 | 88 | 89 | 104 | 105 | 106 | 107 | 108 | 109 | 110 |
| Высшие оксиды | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | ||
| Водородные соед. | RH4 | RH3 | H2R | HR |
| *Лантаноиды | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
| ^Актиноиды | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
Аргумент комплексного числа
Рассмотрим радиус–вектор произвольного, но отличного от нуля, комплексного числа z.
Аргументом комплексного числа z называют угол φ между положительным направлением вещественной оси и радиус-вектором z.
Аргумент комплексного числа z считают положительным, если поворот от положительного направления вещественной оси к радиус-вектору z происходит против часовой стрелки, и отрицательным – в случае поворота по часовой стрелке (см. рис.).
Считается, что комплексное число нуль аргумента не имеет.
Поскольку аргумент любого комплексного числа определяется с точностью до слагаемого 2kπ , где k – произвольное целое число, то вводится, главное значение аргумента, обозначаемое arg z и удовлетворяющее неравенствам:
Тогда оказывается справедливым равенство:
Если для комплексного числа z = x + i y нам известны его модуль r = | z | и его аргумент φ, то мы можем найти вещественную и мнимую части по формулам
| (3) |
Если же комплексное число z = x + i y задано в алгебраической форме, т.е. нам известны числа x и y, то модуль этого числа, конечно же, определяется по формуле
| (4) |
а аргумент определяется в соответствии со следующей Таблицей 1.
Для того, чтобы не загромождать запись, условимся, не оговаривая этого особо, символом k обозначать в Таблице 1 произвольное целое число.
Таблица 1. – Формулы для определения аргумента числа z = x + i y
| Расположениечисла z | Знаки x и y | Главное значение аргумента | Аргумент | Примеры |
| Положительная вещественнаяполуось | x > 0 , y = 0 | φ = 2kπ | ||
x > 0 , y > 0 | ||||
| Положительнаямнимаяполуось | x = 0 , y > 0 | |||
x < 0 , y > 0 | ||||
| Отрицательнаявещественнаяполуось | x < 0 , y = 0 | π | φ = π + 2kπ | |
x < 0 , y < 0 | ||||
| Отрицательнаямнимаяполуось | x = 0 , y < 0 | |||
x > 0 , y < 0 |
| Расположениечисла z | Положительнаявещественнаяполуось |
| Знаки x и y | x > 0 , y = 0 |
| Главноезначениеаргумента | |
| Аргумент | φ = 2kπ |
| Примеры |
| Расположениечисла z | |
| Знаки x и y | x > 0 , y > 0 |
| Главноезначениеаргумента | |
| Аргумент | |
| Примеры |
| Расположениечисла z | Положительнаямнимаяполуось |
| Знаки x и y | x = 0 , y > 0 |
| Главноезначениеаргумента | |
| Аргумент | |
| Примеры |
| Расположениечисла z | |
| Знаки x и y | x < 0 , y > 0 |
| Главноезначениеаргумента | |
| Аргумент | |
| Примеры |
| Расположениечисла z | Отрицательнаявещественнаяполуось |
| Знаки x и y | x < 0 , y = 0 |
| Главноезначениеаргумента | π |
| Аргумент | φ = π + 2kπ |
| Примеры |
| Расположениечисла z | |
| Знаки x и y | x < 0 , y < 0 |
| Главноезначениеаргумента | |
| Аргумент | |
| Примеры |
| Расположениечисла z | Отрицательнаямнимаяполуось |
| Знаки x и y | x = 0 , y < 0 |
| Главноезначениеаргумента | |
| Аргумент | |
| Примеры |
| Расположениечисла z | |
| Знаки x и y | x < 0 , y < 0 |
| Главноезначениеаргумента | |
| Аргумент | |
| Примеры |
Расположение числа z : Положительная вещественная полуось Знаки x и y : x > 0 , y = 0 Главное значение аргумента: Аргумент: φ = 2kπ Примеры: |
Расположение числа z : Знаки x и y : x > 0 , y > 0 Главное значение аргумента: Аргумент: Примеры: |
Расположение числа z : Положительная мнимая полуось Знаки x и y : x = 0 , y > 0 Главное значение аргумента: Аргумент: Примеры: |
Расположение числа z : Знаки x и y : x < 0 , y > 0 Главное значение аргумента: Аргумент: Примеры: |
Расположение числа z : Отрицательная вещественная полуось Знаки x и y : x < 0 , y = 0 Главное значение аргумента: π Аргумент: φ = π + 2kπ Примеры: |
Расположение числа z : Знаки x и y : x < 0 , y < 0 Главное значение аргумента: Аргумент: Примеры: |
Расположение числа z : Отрицательная мнимая полуось Знаки x и y : x = 0 , y < 0 Главное значение аргумента: Аргумент: Примеры: |
Расположение числа z : Знаки x и y : x < 0 , y < 0 Главное значение аргумента: Аргумент: Примеры: |
Обозначение элементов
Каждый элемент в периодической системе Менделеева имеет несколько обозначений:
- название;
- буквенное выражение;
- атомный номер;
- массовое число.
Буквенное, название
В таблице может быть указано полное название вещества (например, Carbon), в таких случаях его располагают под химическим символом.
Символ — это сокращенное название элемента (например, гелий — He).
Иногда в таблице не указываются названия вещества и приводится лишь его химический символ. Обозначения, как правило, состоят из одной или двух латинских букв. Символ элемента расположен в центре соответствующей ячейки в таблице.
Атомный номер
Атомный номер элемента обычно располагается вверху соответствующей ячейки, посередине или в углу. Все элементы имеют атомные номера от 1 до 118. Атомный номер — это всегда целое число.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить по атомной массе элемента, округляя ее до ближайшего целого числа.
Атомная масса указывается внизу ячейки, под символом элемента. Атомная масса — это сумма масс частиц, которые составляют ядро атома (протоны и нейтроны), представляет собой среднюю величину, для большинства элементов записывается в виде десятичной дроби.
Например, фосфор (P) имеет атомную массу равную 30,97376, следовательно, массовое число (количество протонов и нейтронов в ядре) составит 31.
Валентность
Валентность — это свойство элементов образовывать химические связи.
Валентность бывает:
- постоянная;
- переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность по таблице Менделеева несложно:
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества, находящиеся в первой группе главной подгруппы (Li, К) имеют валентность, равную I; элементы, которые располагаются во второй группе главной подгруппы (Mg, Ca) обладают II валентностью. Мышьяк (As) находится в V группе главной подгруппы, следовательно, значение его валентности также будет равняться V. Помимо этого, у вещества есть еще одно значение валентности. Определяется оно по приведенной выше формуле и равняется III.